Retrasar el envejecimiento y alargar la vida es una de las obsesiones de la humanidad.
¡Y hemos realizado grandes avances!
En 100 años hemos doblado nuestra expectativa de vida, pasando de los 40 a más de 80 años.
Pero esta mejora ha venido, en gran parte, dada por intervenciones externas:
- Más comida disponible.
- Más higiene.
- Mejores medicinas.
- Menos guerras.
- Mejor atención a la gente mayor…
Pero aquí viene la mala mala noticia:
Se nos están terminando los trucos.
Aún gastando cantidades ingentes de dinero en investigación sobre cómo retrasar el envejecimiento, los resultados son cada vez menos impresionantes.
¿La razón?
Muy sencilla: hemos llegado al momento donde la mejora tecnológicas solo sirven para compensar un estilo de vida cada vez más malo:
- Somos más sedentarios.
- Vivimos estresados.
- Comemos cada vez peor.
E, Inevitablemente, pagamos el precio de no cuidar nuestro cuerpo.
Pero este gran problema también nos ofrece una increíble oportunidad.
¿Te imaginas que pasaría si combinaras un estilo de vida más saludable con las intervenciones en salud y bienestar que nos ofrece el mundo moderno?
Vivirías más y mejor.

En este artículo encontrarás:
Los mecanismos del envejecimiento
Envejecer es un proceso natural altamente controlado por vías genéticas y procesos bioquímicos muy conservados en la evolución.
Consideramos que un proceso biológico está implicado en el envejecimiento si:
- Se manifiesta durante el envejecimiento normal.
- Su agravamiento experimental acelera el envejecimiento.
- Su mejora experimental retrasa el proceso normal de envejecimiento y, por lo tanto, aumenta la vida útil saludable (1).
De momento la ciencia ha sido capaz de identificar 9 procesos que cumplen estas premisas:
Inestabilidad genómica:
Un denominador común del envejecimiento es la acumulación de daño genético a lo largo de la vida.
La integridad y la estabilidad del ADN se ven continuamente desafiadas por agentes físicos, químicos y biológicos exógenos, así como por amenazas endógenas que incluyen errores de replicación del ADN, reacciones hidrolíticas espontáneas y especies reactivas de oxígeno (ROS). Estas lesiones condicionan un mal funcionamiento celular, la acumulación de errores y, en último término, la muerte celular.
Desgaste de los telómeros:
Los telómeros son unas secuencias de ADN especiales, situadas en los extremos de los cromosomas, que tienen como función principal la protección de la integridad del ADN celular.
En cada división celular se pierde un trozo de ADN de los extremos. Mientras este acortamiento se realiza en la zona de los telómeros no se pierde información genética, pero llega un momento que el agotamiento de los telómeros afecta la viabilidad de la célula. A este proceso se le llama la senescencia replicativa o el límite de Hayflick.
Además, la disfunción patológica de los telómeros acelera el envejecimiento en ratones y humanos, mientras que la estimulación experimental de la telomerasa (enzima que repara los telómeros) puede retrasar el envejecimiento en ratones (2).
Alteraciones epigenéticas:
Este tipo de alteraciones incluye todo aquello que tiene que ver con la regulación de la expresión del DNA como los patrones de metilación, acetilación y la remodelación de la cromatina.
La marca epigenética que más se ha estudiado es la metilación del ADN. Los niveles globales de metilación del ADN aumentan durante los primeros años de vida y luego disminuyen a partir de la edad adulta tardía.
De hecho la metilación de ciertas regiones del ADN está altamente asociada con la edad, hasta el punto qué, actualmente, usamos la metilación del ADN para predecir, con precisión, la edad cronológica.
También se ha observado un aumento en la variabilidad de la metilación del ADN con la edad (3).
Pérdida de proteostasis:
Las células sanas tienen complejos mecanismos para asegurar la integridad de la proteínas (chaperonas, mecanismos proteolíticos y sus reguladores). Estos factores coordinan la síntesis de proteínas, su correcto plegamiento y su degradación.
Durante el envejecimiento esta red de proteostasis va perdiendo su capacidad. La acumulación resultante de proteínas mal plegadas y agregadas afecta, en particular, a las neuronas y es el causante de enfermedades neurodegenerativas cómo el Alzheimer (4).
Detección de nutrientes desregulada:
La activación de procesos de crecimiento o reparación dependen de la biodisponibilidad de ciertos nutrientes. La pérdida de sensibilidad a este nivel también se asocia a procesos de envejecimiento.
Disfunción mitocondrial:
Las mitocondrias son las centrales energéticas de nuestra células.
Su importancia es tal que participan en rutas metabólicas críticas para nuestra supervivencia y están completamente integradas en las redes de señalización intracelular que regulan diversas funciones celulares.
No es sorprendente que los defectos mitocondriales o su desregulación sean elementos clave en el envejecimiento y en sus enfermedades asociadas (cáncer, las enfermedades neurodegenerativas, síndrome metabólico…) (5).
Por otro lado hay varios estudios que indican que una mejora de la función mitocondrial, puede extender la vida útil de los mamíferos (6).
Senescencia celular:
La senescencia celular puede definirse como una detención estable del ciclo celular junto con cambios fenotípicos estereotipados. Es decir, la célula deja de dividirse y pierde la diferenciación que le da una función única en nuestro cuerpo.
La senescencia celular es una respuesta beneficiosa cuando el daño acumulado de una célula se vuelve perjudicial. Pero a lo largo de los años las células senescentes se acumulan en nuestros tejidos. Esta acumulación se ha relacionado con muchas enfermedades asociadas a la edad (7).
Agotamiento de células madre:
Las células madre son células indiferenciadas capaces de transformarse en cualquier tipo de tejido.
La disminución del potencial regenerativo de los tejidos es una de las características más evidentes del envejecimiento.
Mutaciones genéticas, los cambios epigenéticos y el entorno ambiental intrínseco influyen en la funcionalidad de las células madre a lo largo del tiempo.
El agotamiento de las células madre es uno de los principales culpables del envejecimiento de los tejidos y los organismos (8).
Comunicación intercelular alterada:
Existe evidencia convincente de que el envejecimiento no es un fenómeno biológico que ocurre individualmente en una célula, sino que está acoplado a una alteración general en la comunicación intercelular.
Es decir, la comunicación celular permite tamponar los errores asociados al envejecimiento. Cuando la comunicación se ve alterada el envejecimiento se acelera.
La oxidación y el envejecimiento
El oxígeno es imprescindible para la vida, pero al mismo tiempo es el gran responsable de nuestras muertes.
El oxígeno es un gas altamente reactivo, que al entrar en nuestro cuerpo, además de ser usado para “quemar” grasas y carbohidratos también genera unos metabolitos capaces de desencadenar los mecanismos de envejecimiento que hemos mencionado (9).
Nuestro metabolismo ha desarrollado estrategias efectivas para detectar y desintoxicar estas especies reactivas, pero es una batalla que inevitablemente perderemos.
Lo que sí podemos hacer es retrasar este proceso.
Una de las fuentes principales de oxidación son las mitocondrias.
Las mitocondrias metabolizan mediante el ciclo de Krebs y la cadena de transporte de electrones los sustratos energéticos (glucosa y grasa principalmente) para fabricar ATP que es la principal fuente de energía celular.
Una de las claves cuando hablamos de mitocondrias y oxidación es que para obtener energía desde la glucosa tus células usan el complejo mitocondrial 1 mientras que cuando la obtienes de la grasa usan el complejo mitocondrial 2 (10).
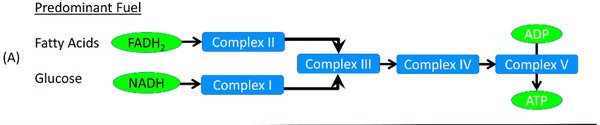
El uso del complejo 1 genera muchísimos más radicales libres (oxidación) que el uso del complejo 2.
👉 Usar glucosa para obtener energía produce más carga oxidativa que si la obtenemos de la grasa (11).
Teniendo esta máxima presente podemos identificar estratégias para minimizar la oxidación.
El ayuno intermitente
Lo primero que haremos para generar el contexto metabólico que favorezca que quememos grasa, es incluir periodos de más de 15 horas sin consumir alimento en nuestra rutina.
Lo que conocemos como ayuno intermitente.
De hecho, la forma en la que validamos el uso del ayuno intermitente como intervención es que durante la mayor parte de la historia de la humanidad lo hemos hecho sin saberlo.
Recuerda que no siempre hemos tenido acceso tan directo a la comida, sino todo lo contrario somos los hijos de 200 millones de años de mamíferos hambrientos y doscientos mil años de humanos hambrientos.
El ayuno intermitente es un “artificio moderno” que simula las dificultades metabólicas que ha sufrido la especie humana durante la mayor parte de su historia y debería entenderse más como un hábito que como una herramienta
👉 Nuestra normalidad histórica ha sido pasar largos periodos en ayunas y es el estado metabólico óptimo para quemar grasa.
Este es un tema tan importante e interesante que le he dedicado varios artículos. Puedes aprender más en esta guía de ayuno intermitente.
La dieta cetogénica
La dieta cetogénica (o dieta keto) consiste en forzar a tu cuerpo a quemar grasas mediante el consumo de mucha grasa y la reducción del consumo de carbohidratos (puedes aprender más sobre dieta cetogénica en este artículo).
No deja de ser un tipo de nutrición que simula las condiciones metabólicas del ayuno.
La ventaja sobre el ayuno intermitente es que con la dieta cetogénica no pasas hambre.
La desventaja es que es más complicada de seguir.
Si te interesa el tema te recomendamos que sigas nuestro curso gratuito de dieta cetogénica.
Un beneficio extra de pasar períodos en cetosis es ganar flexibilidad metabólica y poder transitar con facilidad del metabolismo de los carbohidratos al metabolismo de las grasas.
👉 La flexibilidad metabólica es fundamental para el correcto funcionamiento de la fisiología corporal. También para la prevención del envejecimiento prematuro.
La autofagia
Cómo he comentado, dos de los mecanismos del envejecimiento son la acumulación de células senescentes y de proteínas desnaturalizadas.
Por suerte nuestro cuerpo tiene la capacidad de evitar esta acumulación mediante la autofagia.
Es, por lo tanto, evidente que activar este mecanismo nos ayudará a retrasar el envejecimiento.
Vamos a ver cómo:
Nuestras células usan como moneda energética el ATP (adenosina-trifosfato).
Cuándo las células necesitan energía “rompen” un enlace fosfato y utilizan la energía que se libera. El resultado es ADP, que a su vez puede ser utilizado, si aún necesitamos más energía, transformándolo en AMP.
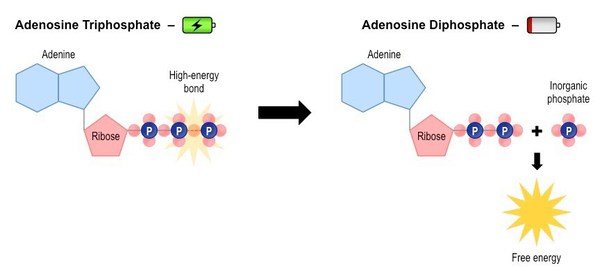
👉 Cuando el AMP se acumula es señal de escasez de energía y se activa una proteína llamada AMPK que activa la autofagia:
- Autoconsumo de los orgánulos celulares que están funcionando mal .
- Eliminación de desechos celulares.
- Activación de la muerte celular programada (apoptosis) de células que están cometiendo demasiados errores y son irreparables.
Esta “limpieza” celular desencadena, posteriormente, un proceso de regeneración donde se crean células nuevas (12).
¿Cómo activar la autofagia?
La estimulación de la autofagia se produce de varias maneras. Las más relevantes son:
- El ayuno prolongado.
- El deporte de intensidad.
- La dieta cetogénica.
- Ciertos bioflavonoides como el té verde, el resveratrol o la quercetina.
Fíjate que si antes hemos hablado de la dieta cetogénica como un mecanismo de disminución de radicales libres ahora debes sumarle el estímulo sobre los procesos de reparación.
Además la AMPK estimula el uso de las grasas por lo que se genera una retroalimentación positiva, el uso de las grasa estimula AMPK y AMPK estimula el uso de las grasas.
Fíjate que todas estas estrategias están asociadas con periodos de carencia
- Ayuno = falta de comida
- Dieta keto = falta de carbohidratos
- Actividad física = falta de alimento, depredadores….
Esto no es casual.
A la naturaleza no le gusta desperdiciar oportunidades.
Cuando algo es inevitable, millones de años de evolución lo transforman en indispensable.
Nuestro cuerpo utiliza los periodos de escasez para regenerarse y los periodos de abundancia para crecer y multiplicarse.
En el mundo moderno, lamentablemente, obstaculizamos la función del AMPK:
- Comemos 5 veces al día.
- No nos movernos.
- Consumimos carbohidratos constantemente y no estimulamos el uso de la grasa como combustible.
¡Así es mucho más difícil que se activen todos estos mecanismos de retorno a la juventud!
👉 En un mundo donde todas las necesidades vitales están cubiertas debemos simular estados de carencia artificial lo suficientemente potentes para activar los mecanismos de reparación y renovación celular.
Recomendaciones finales para retrasar el envejecimiento
No te mueras
Claro, si quieres llegar a los 90 con una salud y energía envidiable es importante no morir antes.
Vivir sin riesgo es imposible y además puede ser muy aburrido.
Mi recomendación es que no corras riesgos innecesarios:
- No sigas retos tontos de Youtube que te propongan comer pastillas de jabón de lavaplatos.
- No pelees con cocodrilos, leones o chimpancés. Vas a perder y seguramente te comerán.
- No te hagas soldado ni mercenario.
- Evita la lava y otras cosas demasiado calientes
Dejando bromas aparte…
Sigue una nutrición anti-envejecimiento
La alimentación es fundamental para retrasar el envejecimiento.
El artículo dieta anti-envejecimiento contiene lo más avanzado en la ciencia anti-envejecimiento y tiene pautas muy fáciles de seguir.
Practica el ayuno intermitente
Cena como máximo hasta a las 8 de la tarde y sáltate el desayuno del día siguiente. Así forzarás a tu cuerpo a usar tus reservas y te sentirás con más energía.
Come menos veces al día
Si comes muchas veces al día, no le das tiempo a tu cuerpo a que se regenere como debe ser. Comiendo dos veces al día, máximo 3, le darás a tu cuerpo tiempo para regenerar tu sistema digestivo.
¡Entrena!
Hacer deporte es una de las intervenciones anti-envejecimiento más potentes.
Puedes saber más sobre qué deporte realizar en este artículo de entrenamiento anti-envejecimiento.
Duerme bien
Este es el momento en el que tu cuerpo aprovecha para reparar todos los tejidos utilizados durante el día. Así que es fundamental que el tiempo para regenerar sea sagrado y no sea interrumpido. Si duermes bien, envejecerás mucho más lento.
Aquí te dejo el mejor artículo del mundo para aprender a dormir mejor.
Prueba la dieta cetogénica
Te recomiendo seguir mi curso gratuito de dieta cetogénica que te explica paso a paso cómo empezar con este protocolo de alimentación y cuáles son los mejores consejos para entrar en cetosis rápido y sin los típicos síntomas iniciales.
Sólo debes clicar en este botón:
Haz un seguimiento de tus marcadores de salud
Realiza una analítica de sangre cada año para ver cómo está funcionando tu cuerpo. Tus marcadores te dirán si lo estás haciendo bien.
Bibliografía
- Carlos López-Otín, Maria A. Blasco, Linda Partridge, Manuel Serrano, Guido Kroemer, The Hallmarks of Aging, Cell, Volume 153, Issue 6, 2013,Pages 1194-1217, ISSN 0092-8674, https://doi.org/10.1016/j.cell.2013.05.039
- Turner, K. J., Vasu, V., & Griffin, D. K. (2019). Telomere Biology and Human Phenotype. Cells, 8(1), 73. https://doi.org/10.3390/cells8010073
- Jones, M. J., Goodman, S. J., & Kobor, M. S. (2015). DNA methylation and healthy human aging. Aging cell, 14(6), 924–932. https://doi.org/10.1111/acel.12349
- Hipp, M. S., Kasturi, P., & Hartl, F. U. (2019). The proteostasis network and its decline in ageing. Nature reviews. Molecular cell biology, 20(7), 421–435. https://doi.org/10.1038/s41580-019-0101-y
- Annesley, S. J., & Fisher, P. R. (2019). Mitochondria in Health and Disease. Cells, 8(7), 680. https://doi.org/10.3390/cells8070680
- Tang B. L. (2016). Sirt1 and the Mitochondria. Molecules and cells, 39(2), 87–95. https://doi.org/10.14348/molcells.2016.2318
- Regulski M. J. (2017). Cellular Senescence: What, Why, and How. Wounds : a compendium of clinical research and practice, 29(6), 168–174. https://pubmed.ncbi.nlm.nih.gov/28682291/
- Goodell, M. A., & Rando, T. A. (2015). Stem cells and healthy aging. Science (New York, N.Y.), 350(6265), 1199–1204. https://doi.org/10.1126/science.aab3388
- Finkel, T., & Holbrook, N. J. (2000). Oxidants, oxidative stress and the biology of ageing. Nature, 408(6809), 239–247. https://doi.org/10.1038/35041687
- Rose, S., Bennuri, S. C., Murray, K. F., Buie, T., Winter, H., & Frye, R. E. (2017). Mitochondrial dysfunction in the gastrointestinal mucosa of children with autism: A blinded case-control study. PloS one, 12(10), e0186377. https://doi.org/10.1371/journal.pone.0186377
- Zhao, R., Jiang, S., Zhang, L., & Yu, Z. (2019). Mitochondrial electron transport chain, ROS generation and uncoupling (Review). International Journal of Molecular Medicine, 44, 3-15. https://doi.org/10.3892/ijmm.2019.4188
- Kim, I., & He, Y. Y. (2013). Targeting the AMP-Activated Protein Kinase for Cancer Prevention and Therapy. Frontiers in oncology, 3, 175. https://doi.org/10.3389/fonc.2013.00175

Soy doctor en Biología Molecular y MBA. Durante 12 años dediqué mi vida a la ciencia. Primero en la Universidad Pompeu Fabra (Barcelona) y más tarde en el Institute for Systems Biology (Seattle, USA). Mi pasión por la optimización de la salud y mi experiencia como científico me han llevado a dedicar mi vida a identificar los descubrimientos sobre cómo mejorar la salud y alargar la vida y experimentarlos en mí mismo.